注:本文不构成任何投资意见和建议,以官方/公司公告为准;本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及),不代表耀海生物立场。任何文章转载需得到授权。
文章导读
科研人员在创新药等生物制药的过程中,建立菌种库的意义在于利用菌种库系统进行充分的质量检测并以此最大程度的控制和减少污染和菌种的性质改变。科研人员为了达到菌种库建立的目的,在建立菌种库时需要菌种库具备足够数量的菌种和维持菌种的均质性,用以确保研发和生产过程中所用的菌种的来源的一致性。
菌种库构建过程主要需要注意以下几个方面
1. 建库用菌种的溯源性
2. 菌种建库过程合规性
3. 建库菌种的检定要求
4. 菌种传代稳定性研究
菌种建库建立的三级种子库包括
1. 原始种子库(pre-master cell bank/research cell bank, PCB/RCB)
2. 主代种子库(master cell bank,MCB):从原始种子批传代、扩增后保存的为主种子库
3. 工作种子库(working cell bank,WCB):从主种子库进行批传代、扩增后保存即为工作种子库
每批种子库都应按规程的要求进行保管、检定和使用。
为了保障生物制品的安全性,必须对其进行严格的检测,确定其达到相关技术标准要求。
耀海生物的菌种库建立以及菌种保存均是依照国家GMP体系的要求执行,并且为了确保产线的稳定运行与菌种库的安全,耀海生物还将WCB单独存放。
一、溯源性
为保证菌种的可溯源性菌种库构建资料要求具备基因、载体和宿主细胞的来源及改造过程。其来源明确清晰,切实可靠,其演化历史也必须清楚。
为确保目的基因的可溯源性菌种库必须确定其来源、设计和改造过程,并且要求来源明确清晰,历史演化过程清楚。
为保证表达载体的可溯源性菌种库构建资料要求具备表达载体的来源、名称、结构等信息,说明重组质粒的构建和检定过程。载体来源应当清楚,明确其出处以及可靠性。
宿主细胞的来源要明确,提供其名称、生物学特性,检定结果等信息。
二、菌种建库过程合规性
建库流程:依照法规规定,从筛选到的高表达菌株单克隆经反复纯化扩增验证后,冻存于-80℃,即为原始种子库。取一只原始种子,复苏后扩增验证,然后混合一定浓度的甘油后在-80℃冻存,即为主种子库。取主种子进行复苏后扩增验证,然后混合一定浓度的甘油后在-80℃冻存,即为工作种子库。所有的种子都要严格记好株名、批号、编号、冻存日期、分装数量、放置位置及取用记录等。
①需在GMP体系完成建库工作,建库流程、储存、运输过程都要形成SOP管理文件。
②保证均质性,如果是使用了多个容器培养,分装前需要有合适的方法充分混匀。
③为保证工作种子库、主种子库与原始种子库的生物学特性一致,建库过程中不得有单克隆挑选和菌种筛选的行为。
GMP标准(药品生产质量管理规范)是为保证药品在规定的质量下持续生产的体系。它是为把药品生产过程中的不合格的危险降低到最小而订立的。GMP包含方方面面的要求,从厂房到地面、设备、人员和培训、卫生、空气和水的纯化、生产和文件。
三、建库菌种的检定要求
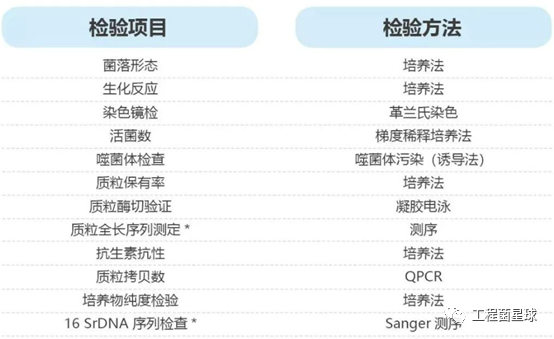
①菌落形态及抗生素抗性,考察菌种在含与不含抗生素华体会体育最新地址 上生长的菌落形态及抗生素抗性。
②生化反应,考察工程菌是否具有典型的大肠杆菌生化反应。
④重组表达载体酶切检定,通过琼脂糖凝胶电泳鉴定重组质粒酶切后DNA片段大小符合理论值。
⑤基因序列测序,验证重组表达载体上的目的基因序列的正确性。
⑥电镜观察,通过电镜观察菌体形态,支原体、病毒样颗粒及其他微生物污染情况。
⑦菌体目的蛋白表达检定,通过SDS-PAGE检测分析重组质粒是否表达目的蛋白。
⑧菌体表达蛋白免疫原性检查,通过Western-blot检测分析重组质粒表达的重组蛋白是否具有正确的免疫原性。
《中国药典》三部中规定了细胞基质的质量要求,包括:细胞鉴别(种属、株及专属特性);外源因子污染检查(包括病毒性及非病毒性内外源因子);成瘤性及致瘤性检测;染色体核型;均一性及稳定性等。
四、菌种传代稳定性研究
根据《中华人民共和国药典》相关要求,种子库要开展传代稳定性研究,明确限传代次数,使用寿命,评估是否能够满足未来商业化生产需求。在开展传代稳定性研究时应在模拟实际的生产条件下开展。通常对重组质粒稳定性和表达稳定性研究的方法为:对种子库菌种多代次培养,通过双酶切检测与菌体PCR检测,确定传代50次后质粒是否丢失。通过对传代50代的菌液诱导培养后,对菌体表达的目的蛋白量进行SDS-PAGE检测,确定传代后的表达稳定性。
耀海生物拥有GMP级别的菌种建库环境以及符合药品注册申报的车间环境,可满足项目中目的蛋白的产量和纯度稳定性。
GMP洁净车间厂址环境和总图布置符合的条件是环境无污染、厂区要整洁、区间不妨碍发展有余地。耀海生物有整洁的生产环境,厂区的地面、路面及运输等不会对制品的生产造成污染,生产、行政、生活和辅助区的总体布局合理,厂区和厂房内的人、物流走向应当合理。耀海生物厂房所处的环境能够尽量降低物料或产品遭受污染。关于GMP洁净区的分级要求可参考下图。

总结
综上所述,三级菌种库的建立不仅仅是为了为菌种的保存和追溯提供切实的依据,而且是在GMP审查以及IND申
时所必需的数据来源。因此在建立三级菌种库之时所需要考虑的不仅包括菌种库本身的基本要求,而且要把IND申报的要求考虑在内。在保证符合国家关于菌种库建立的要求之外,符合IND申报和GMP体系的要求。

本文内容仅代表作者观点,如有侵权请在文章末尾留言给作者,要求删除或联系hth网页入口 后台删除
未经允许不得转载:hth网页入口»【菌周刊】一文全知道|GMP环境下的菌种建库小知识

微信公众号:hth网页入口
关注我们,每天分享更多干货!
18000人已关注

个人介绍:服务覆盖 “重组蛋白/疫苗,质粒/mRNA、纳米抗体”等领域pre-IND至临床Ⅲ期样品制备及商业化生产服务,致力于打造CRO/CDMO/MAH全方位,定制化一站式服务平台。拥有20000平符合GMP要求车间,3000平研发中心,针对客户需求提供50L-2000L定制化服务。相关资讯请联系官方客服耀菌君联系:13380332910(微信同号)




 细胞计数仪应该如何选择?...
细胞计数仪应该如何选择?... 基础操作:图解实验室无菌操作全过程(菌种...
基础操作:图解实验室无菌操作全过程(菌种... 发酵后处理:冻干粉制备工艺、流程及应用领...
发酵后处理:冻干粉制备工艺、流程及应用领... 2021年两院院士增选结果,发酵工程未获...
2021年两院院士增选结果,发酵工程未获... 大肠杆菌发酵经验总结...
大肠杆菌发酵经验总结... 发酵华体会体育最新地址 :华体会体育最新地址 中C、N、P浓度对发酵...
发酵华体会体育最新地址 :华体会体育最新地址 中C、N、P浓度对发酵... hth网页入口 采购区入驻流程...
hth网页入口 采购区入驻流程... 发酵工艺:微藻培养方案之高密度异养发酵法...
发酵工艺:微藻培养方案之高密度异养发酵法...


